INTRODUCCIÓN
|
Al contrario de lo que ocurre con la electrostática, la electrodinámica se caracteriza porque las cargas eléctricas se encuentran en constante movimiento. La electrodinámica se fundamenta, precisamente, en el movimiento de los electrones o cargas eléctricas que emplean como soporte un material conductor de la corriente eléctrica para desplazarse. Todos los cuerpos conocidos en la naturaleza, ya sean sólidos, líquidos o gaseosos, se componen de átomos o moléculas de elementos químicos simples o compuestos. |
|
Las moléculas del agua que tomamos para aliviar la sed, por
ejemplo, están formadas por dos átomos de hidrógeno y uno de oxígeno (H2O). |

|
||
| Formación de una molécula de agua | |||
|
En un vaso de agua están presentes miles de millones de moléculas formadas por esos dos elementos químicos. |
|
La cantidad de protones presentes en el núcleo de un átomo neutro siempre es igual a la de los electrones que se encuentran girando en sus respectivas órbitas. Un átomo en estado neutro tiene el mismo número de cargas negativas que positivas. |
Cuando el átomo cede o pierde electrones se convierte en un ión positivo o catión, pues la cantidad de protones con carga positiva superará a la de los electrones con carga negativa. Si por el contrario, el átomo en lugar de ceder electrones los capta o gana en su última órbita, se convierte en un ión negativo o anión, al ser superior la cantidad de electrones con carga negativa en relación con la carga positiva de los protones agrupados en el núcleo. Es necesario aclarar que el máximo de electrones que puede contener la última capa u órbita de un átomo son ocho.
Electrodinámica
La electrodinámica se fundamenta, precisamente, en el movimiento de los electrones o cargas eléctricas que emplean como soporte un material conductor de la corriente eléctrica para desplazarse.Todos los cuerpos conocidos en la naturaleza, ya sean sólidos, líquidos o gaseosos, se componen de átomos o moléculas de elementos químicos simples o compuestos. Las moléculas del agua que tomamos para aliviar la sed, por ejemplo, están formadas por dos átomos de hidrógeno y uno de oxígeno (H2O).
En un vaso de agua están presentes miles de millones de moléculas formadas por esos dos elementos químicos.
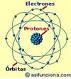
Todos los átomos o moléculas simples se componen de un núcleo formado por protones y neutrones, y alrededor de ese núcleo gira constantemente una nube de electrones situados en una o en varias órbitas, según el elemento químico de que se trate, de forma similar a como giran los planetas alrededor del sol. Es decir, que cada átomo viene siendo un sistema solar en miniatura, tal como se puede ver en la ilustración del átomo de cobre (Cu), que aparece a la izquierda.
Los protones de los átomos poseen siempre carga eléctrica positiva, los neutrones carga neutra y los electrones carga eléctrica negativa.
La cantidad de protones presentes en el núcleo de un átomo neutro siempre es igual a la de los electrones que se encuentran girando en sus respectivas órbitas. Un átomo en estado neutro tiene el mismo número de cargas negativas que positivas.


No hay comentarios:
Publicar un comentario